乳がんの現状(Current status of breast cancer)
乳がんは、女性の約9人に1人*が生涯で乳がんを患います。
(*全国がん登録罹患数・率報告2017年「累積罹患率」10.6%)
40代と60代に発症のピークがあり、40代~50代女性のがん死亡原因の第1位と働き盛りの女性にとっては大変大きな心配事となっています。20代の罹患者数は低い傾向にありますが、乳がん検診を受診する人たちが多いわけではなく、油断は禁物です。
About 1 in 9 women* will develop breast cancer in their lifetime.
Breast cancer strikes hardest in women in their 40s and 60s—and it’s the leading cause of cancer-related death among women in their 40s and 50s, a time when many are at the height of their careers. For working women, it’s a serious and growing concern.
Even in their 20s, when cases are less common, few women get screened—making awareness and early detection more important than ever.
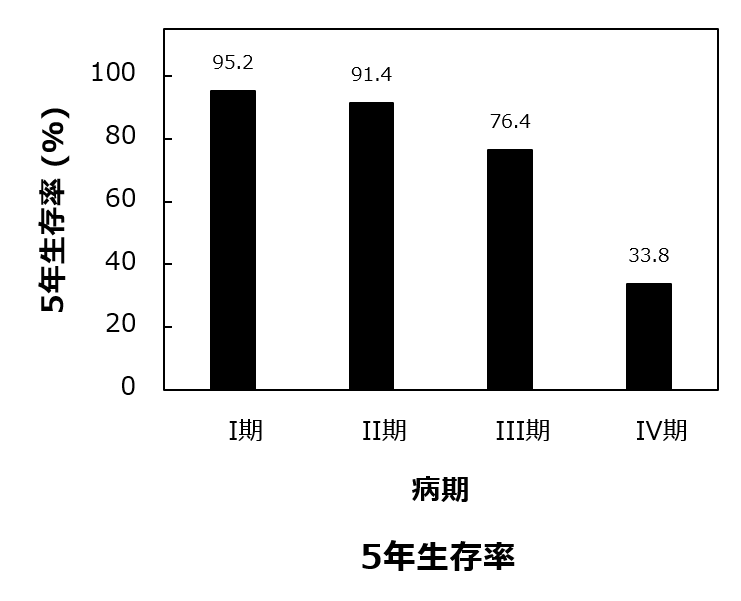
一方、乳がんは寛解する病気です。ステージ1で乳がんが見つかった場合の5年生存率は95.2%と、早期発見により適切な治療が行われれば、良好な経過が期待できます。
(*国立がん研究センターがん対策情報センター「2010-2011年5年生存率集計報告書」)
The good news is, breast cancer is highly treatable—especially when found early.
If detected at Stage 1, the five-year survival rate is an impressive 95.2%. With early diagnosis and proper care, many women go on to live healthy, fulfilling lives.
Early detection isn’t just medical—it’s empowering.
乳がん検診の課題について(Issues on breast cancer screening)
いま乳がんの検診は、主に「マンモグラフィ」という乳房専用の画像検査を行います。透明の圧迫板で乳房をはさんで撮影するため、痛みを伴うことも少なくありません。
Today, breast cancer screening is primarily performed using mammography—an imaging test specifically designed for the breast. This procedure involves compressing the breast between two transparent plates to capture clear images, which many women find uncomfortable or even painful.
日本人女性に多い高濃度乳房は、マンモグラフィの読影を難しくし、正確な診断を妨げがちです。その結果、がん検診、一般検診、人間ドックなどの定期検診による乳がん発見率は24.7%と低いままです。
Dense breast tissue, which is more common among Japanese women, presents another challenge—it makes mammogram interpretation more difficult and often prevents accurate diagnosis.
As a result, the breast cancer detection rate through routine screenings such as cancer checkups, general health exams, and comprehensive medical checkups remains as low as 24.7%.
(*全国がん登録罹患数・率報告2017年「発見経緯」)
*高密度乳房(Dense breast)とは、マンモグラフィーで用いられる定義です。
乳腺組織は、X線が透過しにくいので、X線画像では白く写ります。一方、脂肪組織は透過しやすく黒く写ります。高濃度乳房の場合、高い密度で白く写る乳腺組織のために、乳がんのしこりなどが発見されにくくなります。
What is “dense breast tissue”?
This term refers to a classification used in mammography.
Breast tissue is made up of glandular (dense) tissue and fatty tissue. Glandular tissue appears white on X-ray images because it is less penetrable by X-rays, whereas fatty tissue appears darker.
In women with dense breasts, the higher proportion of white-appearing glandular tissue can obscure abnormalities like tumors, making it more difficult to detect breast cancer on a mammogram.
任意型検診で超音波検査を併用することで、発見率が上昇するとの報告があります。ただし、超音波検査の併用で死亡率減少効果があるかどうかは、いまだ分かっていません。また、追加の費用も必要です。
Combining ultrasound examinations as an optional screening method improves detection rates. However, it remains unclear whether adding ultrasound actually reduces mortality. Additionally, this approach involves additional costs.
(*マンモグラフィと超音波による乳がん検診の感度、特異度 J-START結果報告, 大内憲明ら、Lancet 2016, 387, 341-348.)
また、「早期発見」のため、自治体は行政が費用負担のもと、40歳からのマンモグラフィでの検診を勧めていますが、受診率は50%以下と低迷しています。このような状況から、乳がんの早期発見を増やすためには検診精度と検査方法の改善が必要だと私たちは考えました。
To promote early detection, local governments subsidize mammography screenings starting at age 40. However, the participation rate remains low at less than 50%. Given this situation, we believe that improving both the accuracy of screenings and the testing methods is essential to increase the early detection of breast cancer.
TearExo法について(About the TearExo method)
「病院に行かず自分で簡便にがんリスクを管理できる新たながん検出の開発」ができれば、より早期発見に資すると考え、いつでもどこでも自己採取可能な涙液により乳がんを検出する方法の開発をはじめました。
We believed that creating a new cancer detection method enabling individuals to conveniently manage their cancer risk without visiting a hospital would help promote earlier detection. With this in mind, we began developing a breast cancer detection method using tears—an easily self-collected sample that can be obtained anytime, anywhere.
私達は、乳がんを検出するためのバイオマーカーとして、細胞外小胞(エクソソームとも呼ばれる)に着目しました。細胞外小胞は、あらゆる細胞から放出される脂質の二重膜でおおわれたカプセルです。がん細胞と正常細胞では異なる細胞外小胞を放出すること、細胞外小胞は涙液中にも存在することに着目し、涙液による乳がん検査の可能性を追求しました。
We focused on extracellular vesicles (EVs) as biomarkers for breast cancer detection. These are tiny, lipid bilayer–enclosed capsules—about 100 nanometers in size—secreted by virtually all types of cells. We were particularly interested in the facts that cancer cells release different extracellular vesicles than normal cells, and that these vesicles are also present in tear fluid. Based on this, we explored the potential of using tears for breast cancer screening.
すでに細胞外小胞に対する測定装置のプロトタイプは完成し、従来用いられていた免疫測定法の1,000倍もの高い感度を達成し、実際涙液での測定も可能館ことが示されています。
The prototype measurement device for EVs has already been completed, achieving a sensitivity that is 1,000 times greater than conventional immunoassay methods. It has also been demonstrated that measurements using actual tear samples are feasible.

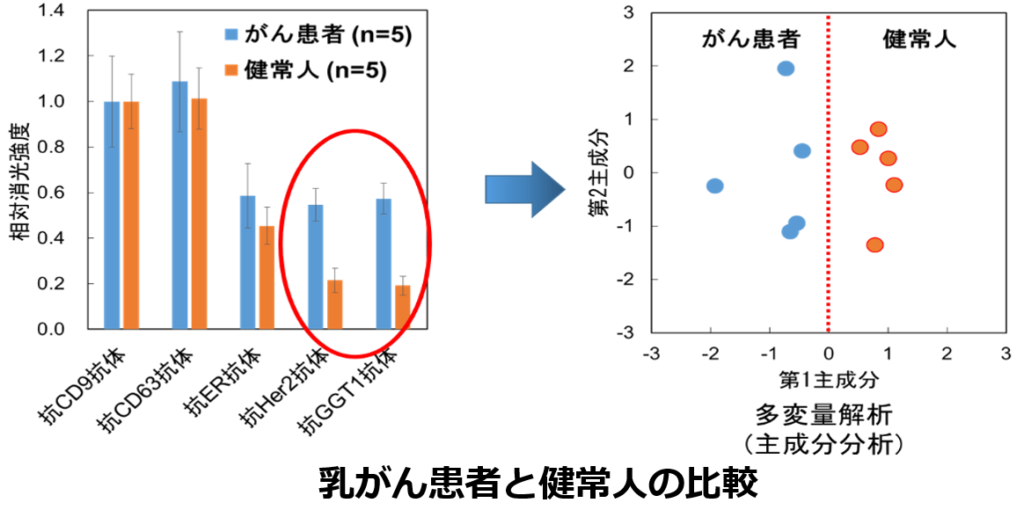
測定装置のプロトタイプを用いて涙を検体としてエクソソームを測定したところ、涙の中のエクソソームを正常に測定でき、乳がん患者とがんがない方のエクソソームの違いも判別することができました。つまり、乳がんの可能性があるないかが、細胞外相をを指標にして確認できることが分かりました。
Using the prototype measurement device, we successfully measured exosomes in tear samples. The device was able to reliably detect exosomes in tears and distinguish between those from breast cancer patients (blue in the figure below) and those from individuals without cancer (orange in the figure below). In other words, we found that the presence or absence of breast cancer can be assessed by using extracellular vesicles as a biomarker.
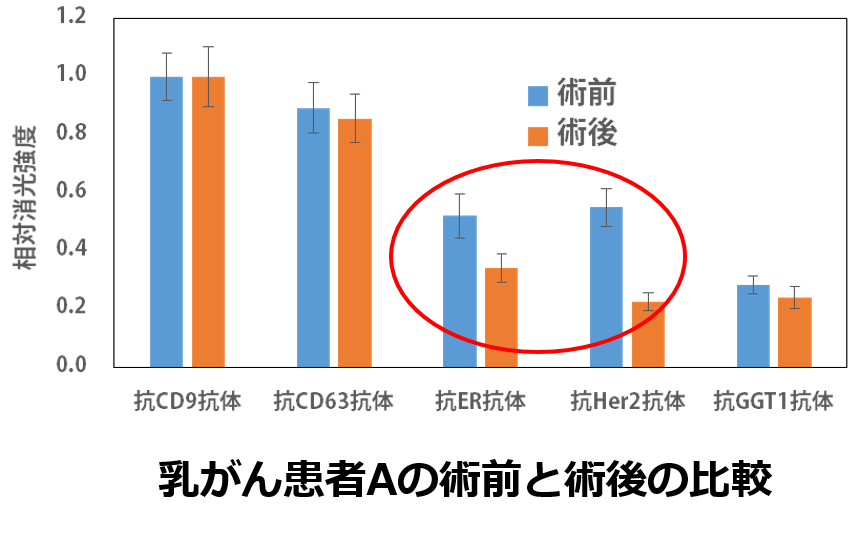
さらに、乳房全摘手術を受けられた患者さんの術前と術後での涙の中のエクソソームは異なることも確認できました。
あくまで予備実験の範囲ですが、涙で乳がんが検出できる可能性があると考えています。
We also observed distinct differences in tear-derived exosomes before and after total mastectomy in breast cancer patients.
Although these findings are based on preliminary experiments, they strongly suggest the potential of using tear analysis for breast cancer detection.
さらに、術後は健常人と同様のエクソソームが検出されたことから、乳がんの検出のみならず、薬物療法の効果、術後の管理、再発リスクのチェックなどの役割でも使用できる可能性が高いのです。
Furthermore, after surgery (orange in the figure below), the exosomes detected in patients’ tears resembled those found in healthy individuals (orange in the above figure). This suggests that tear-based exosome analysis could not only be used for breast cancer detection, but also for monitoring treatment efficacy, postoperative management, and assessing the risk of recurrence.
TearExo法の使用方法 / 測定手順(Measurement procedure)
使用方法は、ドライアイの検査に用いられる「シルマー試験紙」と呼ばれる小さくて薄い短冊状のろ紙片を、目じりに置き、数分目をとじて涙をしみこませます。これだけです。
The procedure is simple. A small, thin strip of filter paper—called a Schirmer’s test strip, commonly used for dry eye testing—is placed at the outer corner of the eye. You simply close your eyes for a few minutes to allow the strip to absorb your tears. That’s all it takes.
このろ紙片をエクソソーム回収溶液に浸し、涙に含まれるエクソソームを回収し、そのまま自動分析装置で分析します。
The test strip is then immersed in an exosome collection solution to extract the exosomes contained in the tears. The sample is subsequently analyzed using the automated measurement device.
鏡を見ながら自己採取も可能ですので、検査のハードルは大きくさがることが期待されます。最終的には、ご自宅で採取したものを検査機関に送ってもらうようなことができれば、病院に行く必要もなくなります。
Since the sample can be self-collected while looking in a mirror, the barriers to testing are expected to be greatly reduced. Ultimately, if individuals can collect samples at home and send them to testing facilities, there would be no need to visit a hospital.
測定手順
TearExo法に関する原著論文(Original papers)
これらの研究成果は、ドイツの化学系トップジャーナルAngewandte Chemie International Edition、および米国の化学系トップジャーナルJouranl of the American Chemical Societyにジャーナルカバーイメージとともに掲載されました
These research findings were published, accompanied by journal cover images, in two leading chemistry journals: Angewandte Chemie International Edition from Germany and the Journal of the American Chemical Society from the United States.
Angew. Chem. Int. Ed. 2019, 58 (6), 1612-1615. DOI: 10.1002/anie.201811142
Mori, K., Hirase, M., Morishige, T., Takano, E., Sunayama, H., Kitayama, Y., Inubushi, S., Sasaki, R., Yashiro, M., Takeuchi, T. A pretreatment-free, polymer-based platform prepared by molecular imprinting and post-imprinting modifications for sensing intact exosomes.

J.Am. Chem. Soc. 2020, 142, 6617-6624. DOI: 10.1021/jacs.9b13874
Takeuchi, T., Mori, K., Sunayama, H., Takano, E., Kitayama, Y., Shimizu, T., Hirose, Y., Inubushi, S., Sasaki, R., Tanino, H. Antibody-conjugated signaling nanocavities fabricated by dynamic molding for detecting cancers using small extracellular vesicle markers from tears.
